ICARIA, Sierra Leone
ICARIA = Improving Care through Azithromycin Research for Infants in Africa (« Améliorer les soins grâce à la recherche sur l’azithromycine pour les nourrissons en Afrique »)

Aperçu
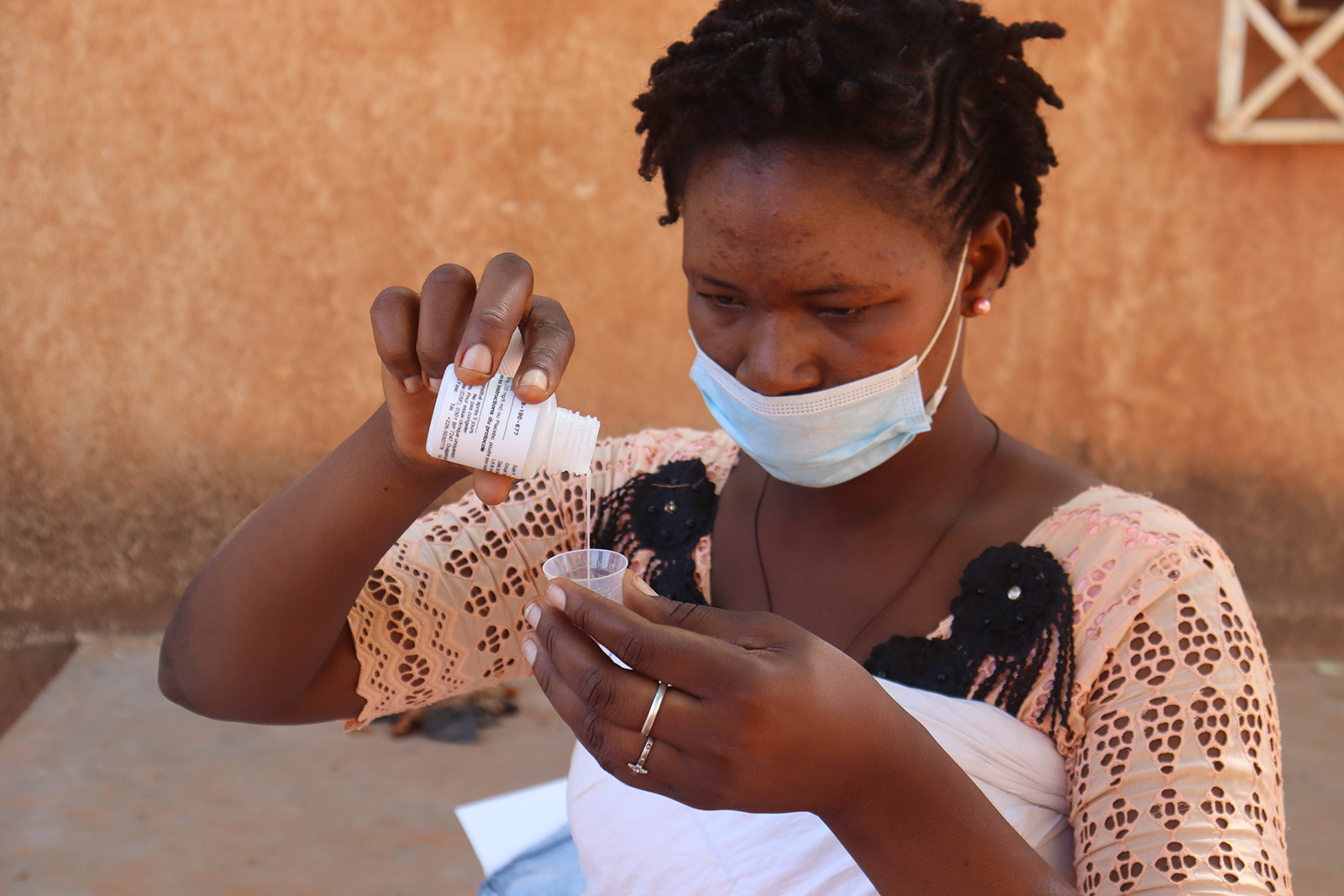
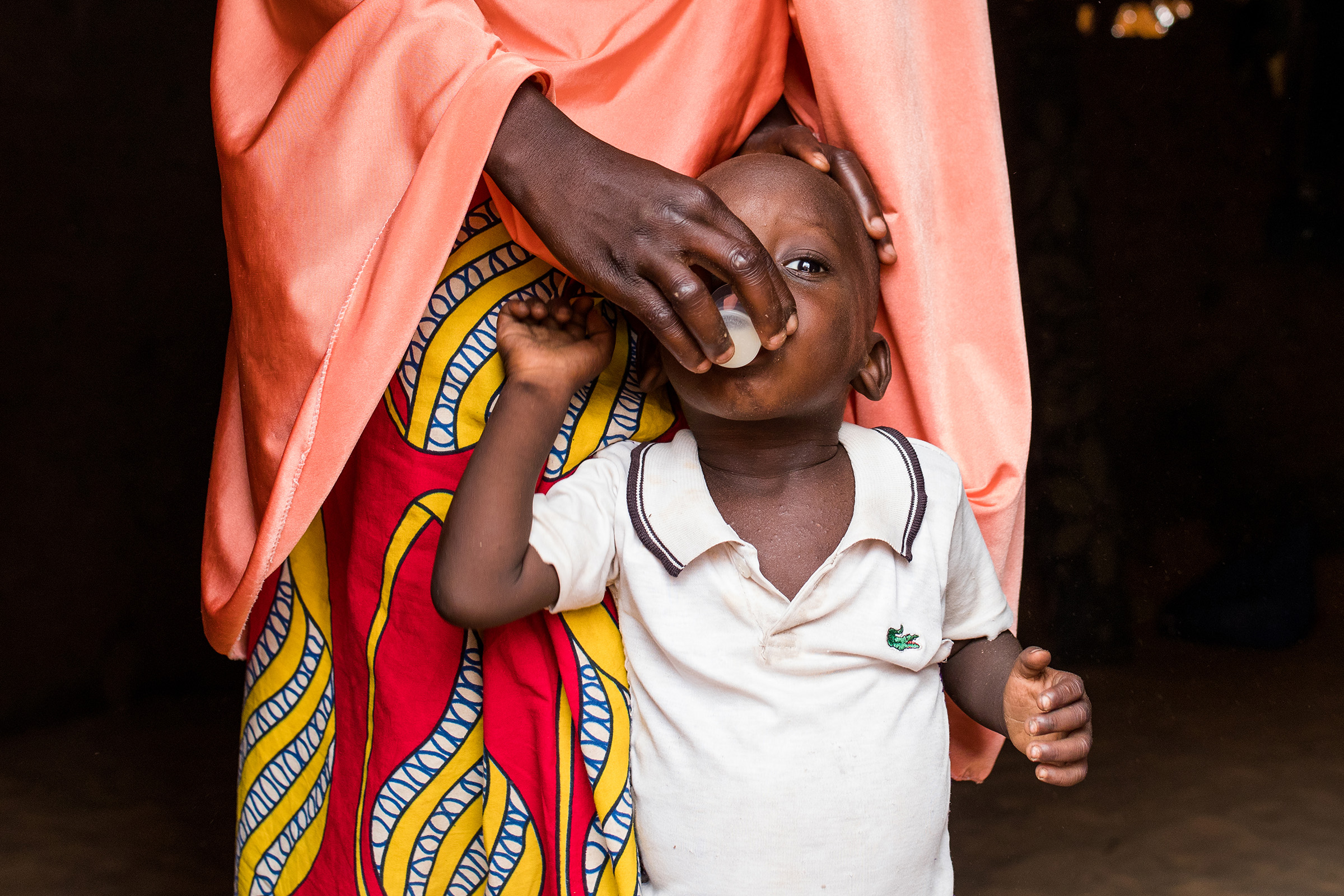
Une évaluation de l’impact sur la mortalité infantile de l’azithromycine associée à la chimioprévention du paludisme pérenne administrée dans le cadre du programme élargi de vaccination en Sierra Leone.
Objectifs
Objectif général
Évaluer l’impact de l’azithromycine administrée dans le cadre du Programme élargi de vaccination en plus de la chimioprévention pérenne du paludisme (CPP) avec la sulfadoxine pyriméthamine (SP) sur la mortalité toutes causes confondues à l’âge de 18 mois en Sierra Leone.
Objectifs spécifiques
1.
Évaluer l’effet sur la mortalité toutes causes confondues jusqu’à l’âge de 18 mois de l’ajout d’azithromycine à 6 semaines, 9 et 15 mois au CPP administré à 10, 14 semaines, 6, 9, 12 et 15 mois, en même temps que les vaccinations de routine du PEV.
2.
Évaluer les effets indésirables associés à l’administration d’azithromycine.
3.
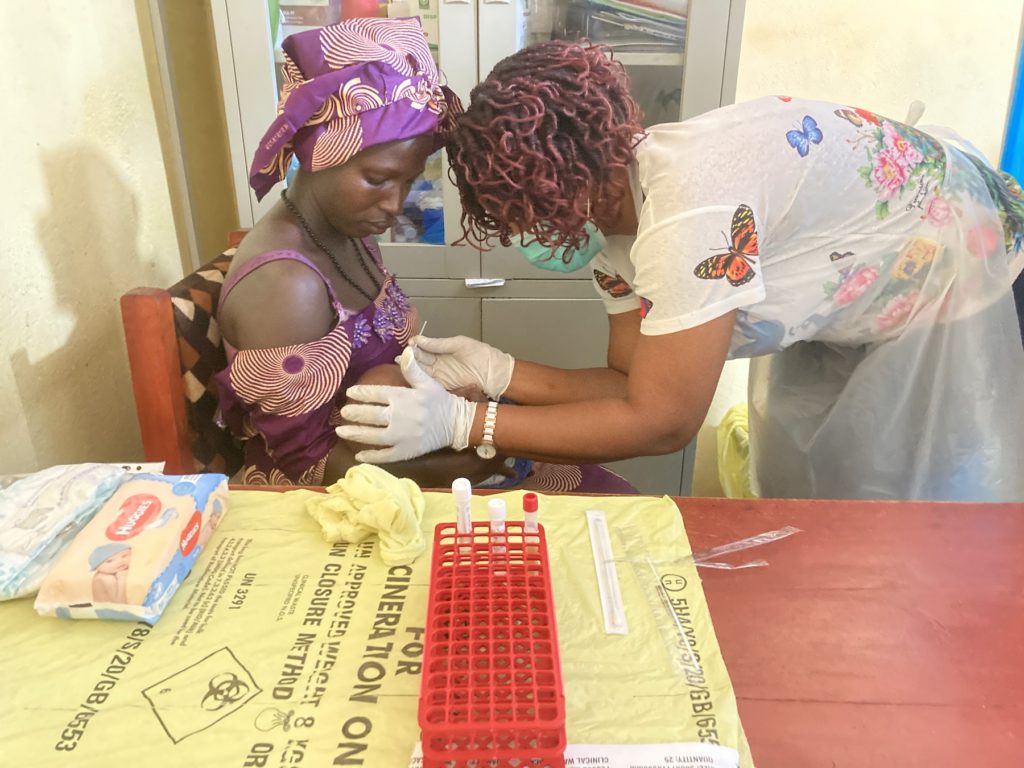
Évaluer le développement potentiel d’une résistance aux macrolides.
4.
Déterminer les interactions potentielles entre l’azithromycine et certaines vaccinations de routine du PEV (rougeole, rubéole et fièvre jaune).
5.
Déterminer l’effet des interventions sur les indicateurs liés au paludisme.
6.
Évaluer le risque potentiel de développement d’une résistance parasitaire au SP.
7.
Examiner les implications pour le système de santé de l’ajout de l’azithromycine au PEV et de l’acceptabilité de cet ajout par les prestataires de soins de santé et les participants.
Conception de l’étude
Essai de phase III, randomisé individuellement, en double aveugle, à deux bras, contrôlé par placebo, portant sur l’administration d’azithromycine / placebo chez des jeunes enfants en Sierra Leone.
Site de l’étude
L’essai est mené dans trois districts de Sierra Leone, à savoir Bombali, Port Loko et Tonkolili, et dans 14 établissements de soins de santé primaires.


Taille de l’échantillon
Un échantillon de 20 560 nourrissons (10 280 par groupe azithromycine / placebo) a été calculé pour parvenir à une réduction de 16,6 % de la mortalité toutes causes confondues à l’âge de 18 mois, avec une puissance statistique de 80 % et une erreur alpha de 0,05.
Critère d’évaluation principal de l’étude
Taux de mortalité toutes causes confondues à l’âge de 18 mois.
Principales étapes
- Premier enfant recruté le 17 mars 2021
- Dernier enfant recruté le 25 avril 2024
- Participants ayant fini leur suivi au 9 octobre 2024 : 13 205 enfants.
- Suivi actif au 9 octobre 2024 : 6 534 enfants
- Fin définitif du suivi prévue en octobre 2025.
Personnel clé et partenaires de l’étude ICARIA
Investigateur principal de l’étude (internationale) :
Prof. Clara Menendez
Investigateur principal de l’étude (Sierra Leone) :
Prof. Mohamed Samai
Partenaires de l’étude (institutions) :
Institut de Barcelone pour la santé mondiale (ISGlobal)
/ Hospital Clínic – Universitat de Barcelona, Espagne
Ministère de la santé,
Gouvernement de Sierra Leone
Collège de médecine et des sciences paramédicales (COMAHS),
Université de Sierra Leone